X線による生体組織中のチタンの状態分析
【1. 緒言】
チタンは金属材料の中でも最も生体親和性に優れているだけでなく、骨結合性が高いことから歯科・医療用インプラント材料として広く用いられている。チタンの高い生体親和性はその優れた化学的耐久性によるものであり、そのため生体内での腐食・溶出やそれに起因する毒性や金属アレルギーを起こさず、最も安全な生体材料であると考えられている。[1-4]
しかしながら一部のチタン製の歯科用インプラントや骨折固定用プレートの周囲組織に金属に起因すると見られる変色(メタローシス)が見られることがあり、同部位を酸溶解してICP(高周波誘導プラズマ)発光分析などで分析すると微量のチタンが検出されることがある。この組織中に含まれるチタンがインプラント手術時などで発生する摩耗粉のような金属チタン粉末か、溶出したチタンに由来するのかはチタン製生体材料の安全性・生体親和性において、重大な関心が持たれるところである。生体内でのチタンの溶解量は極めて微量であり、従来法による元素分布や化学状態の分析は極めて困難である。Ektessabiら[5]はPIXEを用いてチタンインプラント周囲の骨中にチタンが存在し、その濃度がインプラント界面から離れるに従って低下することを報告した。これはチタンインプラント周囲での溶出チタンの分布の初めての報告であるが、チタン濃度が極めて低いため、その化学状態については未だ報告がない。
他方、元素のX線吸収端付近のスペクトルは特有の構造を持ち、XAFS(X-ray Absorption Fine Structure:X線吸収微細構造)と呼ばれ、対象元素の状態を反映する。そのX線源としてシンクロトロン放射光がしばしば用いられる。放射光は通常のX線源に比べて桁違いに強力かつ平行なビームが得られるため、放射光を用いたX線吸収分光測定により微量物質の状態を分析することが可能になる。さらに微量元素の分析に適した蛍光XAFS法を用いることにより、生体中に溶出したチタンのような微量成分の状態分析が可能になると期待される。そこで本研究では歯科用チタンインプラント近傍から採取された粘膜中でのチタンの化学状態を蛍光XAFSにより分析し、インプラントから組織へのチタンの移行について検討した。
【2. 実験方法】
2-1 試料作製: チタンインプラント二次手術の際に患者2名より除去された口腔粘膜組織を凍結乾燥し、以下の分析に供した。なお本実験は北海道大学大学院歯学研究科倫理委員会の認可の元で行った。チタンインプラントの埋入手術においてはインプラント本体を顎骨に埋入後、骨との十分な固定を得るため、インプラントの上部構造をすぐには装着せず、一端インプラントの上部を同じくチタン製のカバースクリューで封鎖し、粘膜を縫合して3〜6ヶ月負荷を与えない。その後、インプラントの上方の粘膜を一部切除して、上部構造を装着する。本実験では患者2名から切除した歯肉組織を、患者さんの了承の下に使用した。
2-2 元素分布分析: X線分析顕微鏡(X-ray Scanning Analytical Microscope: 以下、XSAM(堀場製作所:XGT-2000V))により試料中のTiの分布状態を確認した。観察条件は管電圧・電流=50kV, 1mA(Rhターゲット)とし、3000秒/scanの条件で75回scan・積算して元素分布像を得た。
図2-1はXSAMの概念図を、図2-2は堀場製作所製のX線分析顕微鏡(XGT-5000)の外観を示しており、回転放物内面を持つ中空ガラス管(X線導管)によりX線を100mmまで集光し、試料をX-Y方向に走査しながら蛍光X線スペクトルを測定することで元素分布像を測定するものである。XSAMは大気中で分析可能であるため、EPMAやEDXのように試料の前処理が必要なく、生物試料に向いており、更に重元素については高感度であることを著者らが示している。[6-9]
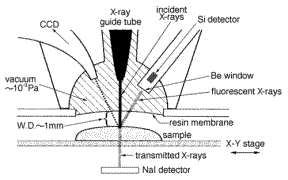
 図2-1,2 X線顕微鏡の概略と外観
図2-1,2 X線顕微鏡の概略と外観
2-3 XAFS測定: XAFS測定は高エネルギー加速器研究機構 物質構造科学研究所 放射光科学研究施設(KEK-PF)BL-9Aにて行った。シンクロトロン放射光はSi(111)モノクロメーターにて分光され、高次光除去用ミラーにより高次高調波を除去した。XSAMにてTiの局在が見られた位置を中心に約1mm四方の面積に入射光を照射し、透過法及び蛍光法によりXANES(X-ray Absorption Near Edge Structure:X線吸収端近傍構造)スペクトルを測定した。蛍光法は19素子半導体により行った。本測定は物質構造化学研究所放射光共同利用実験(課題番号:2004G084)として行われた。
【3. 結果及び考察】
凍結乾燥した2種類(以下、試料A, Bと称す)の歯肉組織のXSAMによる試料のCa, S, Ti分布像を図2-3及び図2-4に示す。
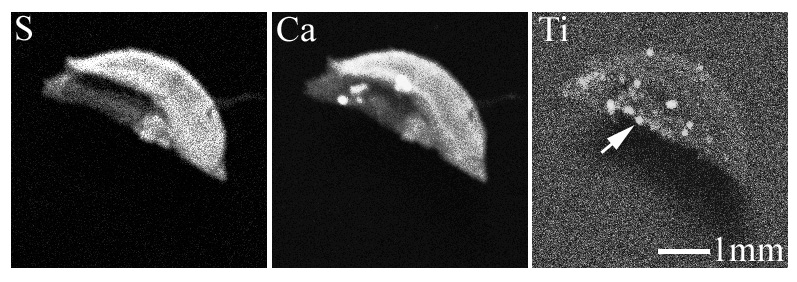
図2-3 試料AのXSAMによるS, Ca, Ti分布像
図2-4 試料BのXSAMによるS, Ca, Ti分布像
S, Caは生体に由来する元素であり、それらの分布像は試料全体の形態を示している。Tiの分布像に於いては、試料内に試料AではTiは点状に局在し、粒子状として存在しているのに対し、試料Bでは試料の一部にTiが比較的均一な濃度で局在している事が分かる。
試料Aの矢印で示した部位及び参照としてTi-foilのTi K-edge XANESスペクトルを図2-5に示す。試料AのスペクトルにはTi-foil即ち金属Tiに特有ないくつかのピークが見られており、同試料中に存在しているTiが金属状態と推測される。図2-3のXSAMの元素分布像からも粒子状物質の存在が観察されており、これらの結果から、試料A中のTiはインプラント埋入時に発生した摩耗粉のような金属Ti粒子と考えられる。通常インプラント埋入時にはタップを切られたインプラント本体の埋入(ねじ込み)やカバースクリューのインプラント本体へのねじ込みなどで摩耗粉が発生する可能性があり、本試料で検出された粒子状Tiは埋入処置の際に生じた摩耗粉である可能性が高いと考えられる。
次に試料BのTi K-edge XANESスペクトルを図2-6に示す。図2-6のスペクトルは図2-5に示した金属Tiのそれとは明らかに異なっており、朝倉ら[10]によるTiO2のTi K-edge XANESスペクトルの研究から、試料B中のTiはanatase型のTiO2であると考えられる。
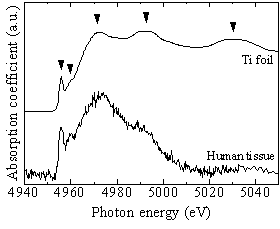 図2-5 試料AのTi K-edge XANESスペクトル
図2-5 試料AのTi K-edge XANESスペクトル 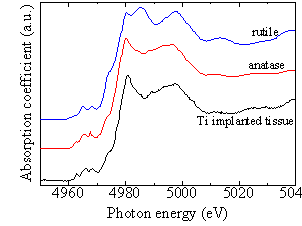 図2-6 試料BのTi K-edge XANESスペクトル
図2-6 試料BのTi K-edge XANESスペクトル
本試料に於いてanataseの形態でTiが生体組織中に存在する理由としては、インプラント表面の酸化物皮膜が脱落して組織中に移行したか、溶出したTiが組織中で酸化物を形成したことが考えられる。試料Bで使用しているインプラント表面は機械加工されたままの表面であり、特に酸化処理などを施されていないことから、インプラント表面から大量の酸化物皮膜が脱落するとは考えにくい。生体内におけるTiの溶出については幾つかの報告があり、長期間接触した組織中に溶出したTiが濃縮される可能性がある。[11-17] しかしながら生体内という比較的穏和な条件下で、XSAMの元素分布像で明らかな局在としてとらえられるほどのTiが溶出することもまた困難と考えられ、その生成メカニズムについては更に検討を要する。
なお両試料ともインプラントの固定は良好であり、術後1〜3年以上を経過しても完全に機能していることから、これら組織中のTiの存在はインプラント手術の正否とは関係しないと考えられる。その理由としてTiは組織中で金属または酸化物の形態でインプラント近傍の組織のみに安定して局在していること、金属Ti及びTiO2いずれも化学的に極めて安定であることが考えられる。[18]
比較として、生体に対して為害性のあるニッケルを動物に埋入した組織中でのNiの溶出状態をXSAMで測定した結果を図2-7に示す。試料左側に純Niが埋入されていた部位があり、その周囲の広い範囲で高濃度にNiが溶出していることが分かる。試作濃度標準試料を用いた溶出Niの濃度は最大で20mM程度と推定された。[9]
光学顕微鏡による組織観察ではNi溶出部に組織の壊死や強い炎症反応が見られており、その組織障害の程度はNi濃度が高い部分ほど強いことが分かった。
図2-7 Ni埋入ラット皮下組織のXSAMによる元素分布像
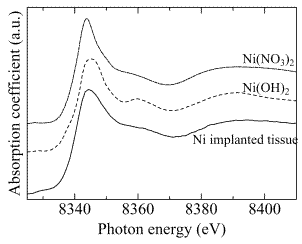
図2-8はNi溶出部位のNi K-edge XANESスペクトルを示す。組織中に溶出したNiのスペクトルはNi(OH)
3などに似たスペクトルを示しており、組織中のNiは水和イオン状態にあると推測された。
Tiの場合には、組織中のTiはインプラント近傍に限局されて存在していること、その状態も金属状態又は酸化物状態と化学的に安定な状態にあるため、拡散しにくいことから、たとえ組織中にTiが移行しても組織に障害を及ぼさないと考えられる。
これに対してNiでは組織中に水和イオン状態で存在するため、広範囲に拡散し、反応しやすい状態にあるため、Niイオン本来の毒性が広範囲で発揮されて、組織に損傷を及ぼすものと推測された。
上記のようにX線分析顕微鏡(XSAM)と蛍光XAFSの組み合わせは生体内の微量元素の分布をXSAMで測定し、高濃度部位を蛍光XAFSで分析して対象元素の状態分析を行うことが可能にした。次の例は本方法を用いて生体内のセレンの分布と状態を調査した例を示す。
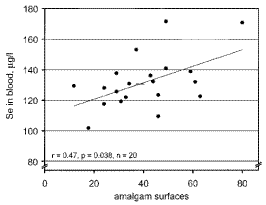
セレンは生体の必須微量元素であり、セレノシステインを含むタンパク(セレノプロテイン)の形で体内に存在している。セレノプロテインは25種類知られており、グルタチオンペルオキシダーゼを代表とした酸化還元酵素が多いが、そのいずれもセレノシステインを活性部位に持つことが分かっている。Molinら[19]やHoelら[20]は図2-9に示すように口腔内のアマルガム修復歯数と血中のセレンに有意な関係があり、溶出した水銀の無毒化にセレンが関与していることを示唆した。これ以降、水銀や銀とセレンの関係については報告がなされているが、いずれも血中濃度との関与を示しており、実際に生体内での水銀とセレンの関与を示した例はない。
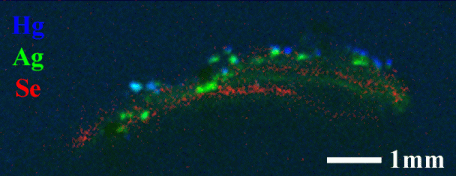
著者らが病理組織検査に供された歯肉組織中の異物をXSAMで分析したところ、異物が歯科用アマルガム様の微粒子であり、その周囲にセレンの局在が見られることを見出した。(図2-10)
図2-10 歯科用アマルガム微粒子を含む組織中での合金成分及びセレンの分布
通常、生体内のセレン濃度は極めて低く(0.17ppm)、XSAMで検出されることはない。ところが上記試料ではアマルガムの微粒子と思われるHgとAg高濃度部近傍に明瞭なSeの分布が見られ、高濃度に濃縮していることを示している。
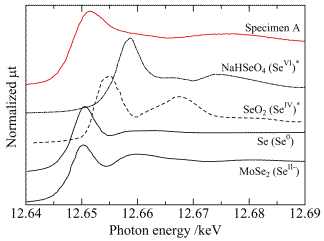
図2-11は上記試料のセレン高濃度部(矢印c)を蛍光XAFS測定した結果である。標準試料のスペクトルからSeのK吸収端は価数の増加と共に高エネルギー側にシフトすると考えられ、当該試料のスペクトル(一番上)は吸収端位置とスペクトル形状から低価数状態にあり、周囲と強い相互作用をしていないことが推測された。[21]
以上のように、本研究で用いた方法は生体内で溶出した微量金属元素や、その他の生体内微量元素の分析に極めて有効であることが示された。
【4. 結言】
チタンインプラント近傍の口腔粘膜およびNi埋入動物軟組織を蛍光XAFS法及びX線分析顕微鏡により分析した結果、以下の知見を得た。
・生体組織中の微量金属元素の分布と化学状態をX線分析顕微鏡と蛍光XAFS法により分析可能であった。
・Tiは金属粒子または酸化物(anatase)状態で埋入部近傍に局在することが判明した。但し組織中のTiの存在はインプラントの成否と無関係であった。これは組織中のTiが化学的に安定な状態でインプラント近傍に限局して存在するためと考えられた。
・Niは水和イオン状態で組織中に溶出しており、同溶出部位には強い障害が見られた。TiとNiの生体為害性の違いは組織中での状態の差が一因と考えられた。
・本方法は他の生体内微量元素(セレンなど)の分析にも有用であることが示唆された。
【参考文献】
1. Schliephake H, Reiss G, Urban R, Neukam FW, Guckel S. Metal release from titanium fixtures during placement in the mandible: An experimental study. Int. J. Oral Maxillofac. Implants 1993; 8: 502-11.
2. Hallab NJ, Skipor A, Jacobs JJ. Interfacial kinetics of titanium- and cobalt-based implant alloys in human serum: Metal release and biofilm formation. J. Biomed. Mater. Res., 2002; 65A: 311-8.
3. Kasai Y, Iida R, Uchida A. Metal concentration in the serum and hair of patients with titanium alloy spinal implants. Spine 2003; 28: 1320-6.
4. Ferrari F, Miotello A, Pavloski L, Galvanetto E, Moschini G, Galassini S, Passi P, Bogdanovic S, Fazinic S, Jaksic M, Valkovic V. Metal-ion release from titanium and TiN coated implants in rat bone. Nucl. Instr. and Meth. B. 1993; B79: 421-3.
5. Ektessabi AM, Otsuka T, Tsuboi Y, Yokoyama K, Albrektsson T. Sennerby L, Johansson C, Application of micro beam PIXE to detection of titanium ion release from dental and orthopaedic implants. Int. J. PIXE 1994; 4: 81-91.
6. Uo M, Watari F, Yokoyama A, Matsuno H, Kawasaki T. Dissolution of nickel and tissue response observed by X-ray scanning analytical microscope. Biomaterials 1999; 20: 747-55.
7. Uo M, Watari F, Yokoyama A, Matsuno H, Kawasaki T. Tissue reaction around metal implants observed by X-ray scanning analytical microscopy. Biomaterials 2001; 22: 677-85.
8. Uo M, Watari F, Yokoyama A, Matsuno H, Kawasaki T. Comparison of XSAM and EPMA in elemental map imaging of unstained soft tissue and detectability of rare content of dissolved elements. Biomaterials 2001; 22: 1787-94
9. Uo M, Tanaka M, Watari F, Quantitative analysis of biological specimens by X-ray scanning analytical microscope. J. Biomed. Mater. Res. PartB : Appl Biomater. 2004; 70B: 146-151.11
10. Asakura K, Inukai J, Iwasawa Y. Structure of one atomic layer titanium oxide on silica and its palladium-mediated restructuring. J. Phys. Chem. 1992; 96: 829-34.
11. Khan MA, Williams RL, Williams DF. In-vitro corrosion and wear of titanium alloys in the biological environment. Biomaterials 1996; 17: 2117-26.
12. Cai Z, Nakajima H, Woldu M, Berglund A, Bergman M, Okabe T. In vitro corrosion resistance of titanium made using different fabrication methods. Biomaterials 1999; 20: 183-90.
13. Grosgogeat B, Reclaru L, Lissac M, Dalard F. Measurement and evaluation of galvanic corrosion between titanium/Ti6Al4V implants and dental alloys by electrochemical techniques and auger spectrometry. Biomaterials 1999; 20: 933-41.
14. Hanawa T, Hiromoto S, Asami K, Okuno O, Asaoka K. Surface oxide films on titanium alloys regenerated in Hanks' solution. Mater Trans 2002; 43: 3000-4
15. Cai Z, Shafer T, Watanabe I, Nunn ME, Okabe T. Electrochemical characterization of cast titanium alloys. Biomaterials 2003; 24: 213-8.
16. Takahashi M, Kikuchi M, Takada Y, Okuno O, Okabe T. Corrosion behabior and microstructure of experimental Ti-Au alloys. Dent Mater J 2004; 23: 109-116.
17. Takemoto S, Hattori M, Yoshinari M, Kawada E, Asami K, Oda Y. Corrosion behavior and surface characterization of Ti-20Cr alloy in a solution containing fluoride. Dent Mater J 2004; 23: 379-386.
18. Uo M, Asakura K, Yokoyama A, Tamura K, Totsuka Y, Akasaka T, Watari F. Analysis of titanium dental implants surrounding soft tissue using X-ray absorption fine structure (XAFS) analysis. Chem Lett 2005; 34: 776-7
19. Molin M, Bergman B, Marklund SL, Schütz A, Skerfving S. Mercury, selenium and glutathione peroxidase before and after amalgam removal in man. Acta Odontol. Scand., 48, 189 (1990)
20. Hoel PJ, Vamnes JS, Gjerdet NR, Eide R, Isrenn R. Dental amalgam and selenium in blood. Environ Res 2001; 87A: 141-6
21. Uo M, Asakura K, Kohgo T, Watari F. Selenium distribution in human soft tissue determined by using X-ray scanning analytical microscope and X-ray absorption fine structure analysis. Chem Lett 2006; 35: 66-7
22. 山本 融. 電力中央研究所報告 2004; W03034: 1-4

 図2-1,2 X線顕微鏡の概略と外観
図2-1,2 X線顕微鏡の概略と外観
 図2-1,2 X線顕微鏡の概略と外観
図2-1,2 X線顕微鏡の概略と外観
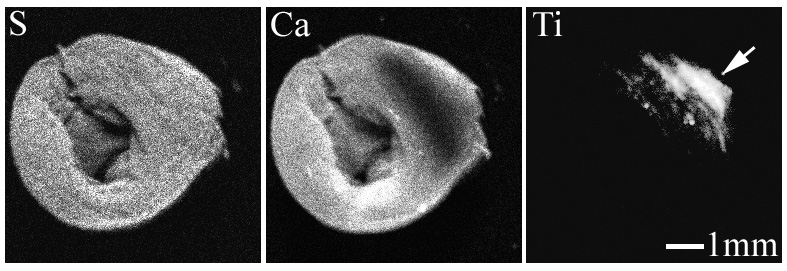
 図2-5 試料AのTi K-edge XANESスペクトル
図2-5 試料AのTi K-edge XANESスペクトル  図2-6 試料BのTi K-edge XANESスペクトル
図2-6 試料BのTi K-edge XANESスペクトル
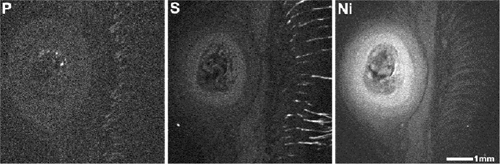
 図2-8はNi溶出部位のNi K-edge XANESスペクトルを示す。組織中に溶出したNiのスペクトルはNi(OH)3などに似たスペクトルを示しており、組織中のNiは水和イオン状態にあると推測された。
図2-8はNi溶出部位のNi K-edge XANESスペクトルを示す。組織中に溶出したNiのスペクトルはNi(OH)3などに似たスペクトルを示しており、組織中のNiは水和イオン状態にあると推測された。
 セレンは生体の必須微量元素であり、セレノシステインを含むタンパク(セレノプロテイン)の形で体内に存在している。セレノプロテインは25種類知られており、グルタチオンペルオキシダーゼを代表とした酸化還元酵素が多いが、そのいずれもセレノシステインを活性部位に持つことが分かっている。Molinら[19]やHoelら[20]は図2-9に示すように口腔内のアマルガム修復歯数と血中のセレンに有意な関係があり、溶出した水銀の無毒化にセレンが関与していることを示唆した。これ以降、水銀や銀とセレンの関係については報告がなされているが、いずれも血中濃度との関与を示しており、実際に生体内での水銀とセレンの関与を示した例はない。
セレンは生体の必須微量元素であり、セレノシステインを含むタンパク(セレノプロテイン)の形で体内に存在している。セレノプロテインは25種類知られており、グルタチオンペルオキシダーゼを代表とした酸化還元酵素が多いが、そのいずれもセレノシステインを活性部位に持つことが分かっている。Molinら[19]やHoelら[20]は図2-9に示すように口腔内のアマルガム修復歯数と血中のセレンに有意な関係があり、溶出した水銀の無毒化にセレンが関与していることを示唆した。これ以降、水銀や銀とセレンの関係については報告がなされているが、いずれも血中濃度との関与を示しており、実際に生体内での水銀とセレンの関与を示した例はない。