仢懡岴幙僈儔僗
侾丏偼偠傔偵
丂柍婡懡岴幙嵽椏偲偼懡岴幙僈儔僗傗懡岴幙僙儔儈僢僋僗偺傛偆偵撪晹偵柍悢偺旝嵶側岴傪桳偟偨柍婡嵽椏偱偁傝丄柍婡懡岴幙嵽椏偼桳婡宯偺懡岴幙嵽椏偵斾傋偰埲壓偺傛偆側摿挜傪桳偟偰偄傞丅
(1)嵶岴宎傪悢nm乣栺10兪倣偺娫偱惂屼壜擻偱偁傝丄僔儍乕僾側嵶岴暘晍傪帩偮
丂懡岴懱偑摼傜傟傞丅
(2)崪奿偑巁壔暔偐傜側傞偨傔懴擬惈偵桪傟丄庬乆偺桳婡梟攠傗巁偺塭嬁傪庴偗偢
丂旝惗暔偵傕怤偝傟側偄丅
(3)婡夿揑嫮搙偵桪傟丄斀墳梕婍撪偱偺悺朄埨掕惈偑崅偄丅
(4)昞柺廋忺偑梕堈偱偁傞丅
偙偺摿挜傪惗偐偟偰丄柍婡懡岴幙嵽椏偼暘棧枌傗怗攠扴懱側偳懡曽柺偵墳梡偝傟偰偍傝丄墳梡偺堦偮偵峺慺丒旝惗暔摍偺屌掕壔扴懱偲偟偰僶僀僆僥僋僲儘僕乕傊偺墳梡傕帋傒傜傟偰偄傞丅
 嵍婰偵懡岴幙僈儔僗偺SEM幨恀傪帵偡丅
嵍婰偵懡岴幙僈儔僗偺SEM幨恀傪帵偡丅
俀丏柍婡懡岴幙嵽椏偺崌惉
(1)懡岴幙僈儔僗
丂懡岴幙僈儔僗偼1940擭崰偵暷崙偺摿庩僈儔僗儊乕僇乕偱偁傞僐乕僯儞僌幮偵傛傝奐敪偝傟偨丅偙偺懡岴幙僈儔僗傪崅壏偱張棟偟丄柍岴壔偟偨傕偺偼96亾偺崅働僀巁幙偱乽僶僀僐乕儖僈儔僗乿偺彜昗偱抦傜傟偰偍傝丄懡岴幙僈儔僗偼乽僶僀僐乕儖僈儔僗乿偺拞娫惢昳偲偟偰摼傜傟偨傕偺偱偁偭偨偑丄嬒堦側宎偺娧捠嵶岴傪帩偪丄嵟戝偱悢昐m2乛g偺斾昞柺愊傪帩偮偙偲偐傜丄懡岴懱偲偟偰偺墳梡偑尋媶偝傟傞傛偆偵側偭偨丅懡岴幙僈儔僗偺崌惉曽朄偼僈儔僗偺憡暘棧尰徾傪岻柇偵棙梡偟偰偄傞揰偱旕忢偵嫽枴怺偄丅
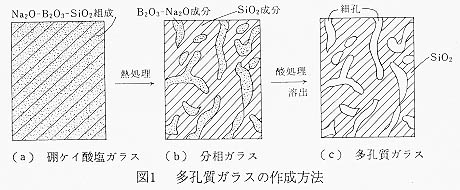
忋恾偼偦偺岺掱傪帵偟偰偍傝丄尨椏偲側傞SiO2乮働僀嵒乯,H3BO3乮犴巁乯,Na2CO3乮僜乕僟奃乯偐傜捠忢偺梟梈僾儘僙僗偵傛傝Na2O-B2O3-SiO2宯僈儔僗傪嶌惢偟乮恾1(a)乯丄偙傟傪惉宍偟偨屻偵悢昐亷偱擬張棟傪峴偆偲丄僈儔僗撪晹偱SiO2儕僢僠憡偲Na2O-B2O3儕僢僠憡偵悢nm偺僗働乕儖偱僗僺僲乕僟儖暘夝偵傛傞暘憡偑偍偙傞乮恾1(b)乯丅偙偺暘憡僈儔僗傪巁梟塼偵怹捫偡傞偲丄Na2O-B2O3憡偺傒偑巁偱梟弌偝傟丄恾1(c)偺傛偆偵SiO2崪奿傪帩偮懡岴幙僈儔僗偑摼傜傟傞丅
偙偺曽朄偱摼傜傟傞懡岴幙僈儔僗偺嵶岴偼昞柺偐傜撪晹傑偱楢寢偟偨娧捠嵶岴偱偁傝丄嵶岴宎偼擬張棟忦審偵傛傝梕堈偵惂屼偱偒傞丅埲忋偼婎杮揑側岺掱偱偁傝丄幚嵺偵偼僈儔僗慻惉傗擬張棟忦審側偳儊乕僇乕偵傛偭偰庬乆偺岺晇偑堊偝傟偰偄傞丅
(2)懡岴幙僙儔儈僢僋僗
丂懡岴幙僙儔儈僢僋僗偼嵶岴宎偑僆儞僌僗僩儘乕儉扨埵偐傜mm扨埵偺峀偄斖埻偵搉傝丄庡偵棻巕宎傪惂屼偟偨崪嵽棻巕傪從寢偟偰摼傜傟傞丅懡岴幙僙儔儈僢僋僗偵偼僛僆儔僀僩偺傛偆偵寢徎峔憿撪偺嬻寗傪嵶岴偲偡傞傕偺偲丄傾儖儈僫側偳偺旝棻巕寢崌懱偺棻巕娫寗傪嵶岴偲偡傞傕偺偑偁傝丄岺嬈揑偵峀偔棙梡偝傟偰偄傞丅
傑偨嬤擭丄懡岴幙僈儔僗偲摨條偵鉱枾懱偺堦晹傪梟弌偟偰懡岴幙僙儔儈僢僋僗傪嶌惉偡傞曽朄偑峫埬偝傟偰偄傞丅CaO-TiO2-P2O5宯僈儔僗偐傜CaTi4(PO4)6媦傃Ca3(PO4)2寢徎傪愅弌偝偣丄Ca3(PO4)2寢徎偺傒傪梟弌偡傞帠偱嵶岴暘晍偺懙偭偨懡岴幙僙儔儈僢僋僗傪摼傜傟傞帠偑曬崘偝傟偰偄傞丅
(3)僝儖乕僎儖朄偵傛傞懡岴幙僎儖
丂嬤擭丄怴偟偄僈儔僗偺惢憿朄偲偟偰拲栚偝傟偰偄傞僝儖乕僎儖朄偼丄嬥懏偺桳婡媦傃柍婡壔崌暔偺梟塼傪僎儖偲偟偰屌壔偟丄僎儖傪姡憞丒壛擬偟巁壔暔屌懱傪嶌惉偡傞曽朄偱偁傞丅尰嵼丄峀偔梡偄傜傟偰偄傞嬥懏傾儖僐僉僔僪梟塼傪梡偄偨僝儖乕僎儖朄偱偼傾儖僐僉僔僪偺壛悈暘夝斀墳偲扙悈弅崌斀墳偵傛傝僎儖壔偑恑峴偡傞丅椺偊偽僥僩儔僄僩僉僔僔儔儞傪尨椏偲偟偨偲偒偺壛悈暘夝丒扙悈弅崌斀墳偼偦傟偧傟(1),(2)幃偱帵偝傟傞丅
丂丂Si(OC2H5)4
亄 4H2O 仺 Si(OH)4 亄 4C2H5OH仾 丒丒丒(1)
丂丂Si(OH)4 仺 SiO2 亄 2H2O仾 丒丒丒(2)
(2)幃偺扙悈弅崌斀墳偺寢壥摼傜傟傞僔儕僇僎儖偼撪晹偵梟攠傗悈傪娷傒丄偦傟帺懱偑懡岴懱偱偁傝丄撪晹偵悢nm掱搙偺柍悢偺嵶岴傪桳偟偰偄傞丅乮捠忢偼鉱枾側僈儔僗傪摼傞偨傔丄偙偺懡岴惈僎儖傪從惉偡傞乯
壓恾偼僝儖乕僎儖朄偵傛傞僈儔僗偺崌惉夁掱傪柾幃揑偵帵偟偨傕偺偱偁傞丅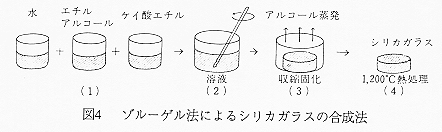
傑偨僝儖乕僎儖朄偺弌敪梟塼偵桳婡崅暘巕傪崿崌偡傞偙偲偵傛傝兪倣僆乕僟乕偺嵶岴傪帩偮懡岴幙僎儖偑摼傜傟傞偙偲偑曬崘偝傟偰偄傞丅偙傟偼僎儖壔偺恑峴偵敽偄丄惗惉偟偨僔儕僇廳崌懱偲桳婡崅暘巕傪娷傓梟攠偲偺僗僺僲乕僟儖暘夝偵傛傝宍惉偝傟偨暘憡峔憿偑僎儖壔偵傛傝屌掕偝傟傞偨傔偱偁傝丄弌敪梟塼拞偺桳婡崅暘巕傗悈偺擹搙丄媦傃僎儖壔帪偺壏搙偵傛傝嵶岴宎傪惂屼偡傞帠偑壜擻偱偁傞丅傑偨僝儖乕僎儖朄偵傛傞偲柍婡僎儖傪掅壏偱崌惉偱偒傞偨傔丄僎儖撪晹偵峺慺傗旝惗暔摍傪曪妵偡傞偙偲偑壜擻偱偁傞丅
係. 惗懱怗攠偺屌掕壔
丂旝惗暔妛傗惗壔妛偺恑曕偵傛傝旝惗暔傗峺慺摍偺惗懱怗攠偑峀偔岺嬈偵棙梡偝傟傞傛偆偵側偭偨偑丄懡偔偺応崌偦偺僾儘僙僗偼僶僢僠幃丄偡側傢偪婎幙梟塼偵惗懱怗攠傪搳擖偟丄斀墳屻偵彍嫀偡傞曽朄偑庢傜傟偰偒偨丅偙偺曽朄偱偼奺僶僢僠枅偵戝宆偺斀墳憛傪梡堄偡傞昁梫偑偁傝丄戝宆偺僾儔儞僩偑昁梫偵側傞忋丄堦搙巊梡偝傟偨惗懱怗攠傪夞廂偟嵞棙梡偡傞偺偼嬌傔偰崲擄偱偁傞丅偙傟偱偼峺慺傗旝惗暔傪堦斀墳枅偵幪偰傞偙偲偵側傝峺慺偺惛惢傗旝惗暔偺攟梴偵昁梫側僐僗僩傪峫偊傞偲丄旕忢偵晄宱嵪側巊梡曽朄偱偁傞丅
丂偦偙偱惗懱怗攠傪屌懱昞柺乮撪晹乯偵屌拝偟偨忬懺偱棙梡偟丄夞廂偡傞帠偑峫偊傜傟偨丅偙傟偑屌掕壔惗懱怗攠乮屌掕壔峺慺丄屌掕壔旝惗暔乯偱偁傞丅
屌掕壔惗懱怗攠傪梡偄傞偲師偺傛偆側棙揰偑偁傞丅
(1)斀墳偺奐巒丄掆巭傪屌掕壔峺慺偺揧壛丄彍嫀偵傛傝梕堈偵惂屼偱偒傞
(2)惗懱怗攠偲惗惉暔偲偺暘棧偑梕堈偵側傝丄僾儘僙僗傪娙慺壔偱偒傞
(3)屌掕壔惗懱怗攠傪廩揢偟偨僇儔儉偵尨椏梟塼傪捠偡偙偲偱斀墳傪恑峴偝偣傜傟傞偺偱丄憰抲傪彫宆壔偱偒傞
(4)惗懱怗攠傪孞傝曉偟巊梡弌棃傞偺偱宱嵪揑偱偁傞
(5)屌掕壔偵傛傝峺慺傗旝惗暔偺埨掕惈偑岦忋偡傞乮応崌偑偁傞乯
丂惗懱怗攠傪屌懱昞柺偵屌掕壔偡傞曽朄偼偙傟傑偱偵悢懡偔奐敪偝傟偰偍傝丄偦傟傜偼師偺嶰庬椶偺曽朄偵戝暿偝傟傞丅壓恾偼偦傟傜傪柾幃揑偵帵偟偨傕偺偱偁傞丅
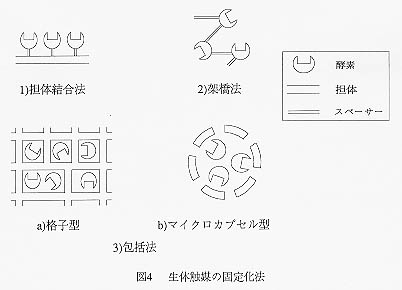
(1)扴懱寢崌朄丗悈晄梟惈偺扴懱偵峺慺傪寢崌偝偣傞曽朄
(2)壦嫶朄丗扴懱傪巊梡偣偢偵峺慺傪俀屄傕偟偔偼偦傟埲忋偺姱擻婎傪帩偮帋栻偲
丂壦嫶斀墳偝偣偰晄梟壔偡傞曽朄
(3)曪妵朄丗峺慺傪僎儖偺旝嵶側奿巕偺拞偵曪傒崬傓偐丄敿摟惈偺億儕儅乕偺旂枌
丂偵傛偭偰旐暍偡傞曽朄
丂惗懱怗攠傪屌掕壔偡傞偨傔偺扴懱偲偟偰偼僙儖儘乕僗摍偺懡摐椶傗億儕價僯儖傾儖僐乕儖丆億儕僗僠儗儞摍偺桳婡宯扴懱偲嫟偵懡岴幙僈儔僗丄懡岴幙僙儔儈僢僋僗摍偺柍婡懡岴幙嵽椏傕峀偔梡偄傜傟偰偄傞丅埲壓偵峺慺媦傃旝惗暔傪懡岴幙僈儔僗丒僙儔儈僢僋僗偵屌掕壔偡傞曽朄偲墳梡椺傪帵偡丅
俆. 屌掕壔峺慺
丂懡岴幙僈儔僗偼偦偺峀偄斾昞柺愊傗懴壔妛惈偐傜峺慺屌掕壔梡偺扴懱傗傾僼傿僯僥傿乕僋儘儅僩僌儔僼傿乕梡偺扴懱偲偟偰屆偔偐傜梡偄傜傟偰偒偨丅摿偵億乕儔僗僶僀僐乕儖僈儔僗偼乬Controlled
Porous Glass (CPG)乭偲偄偆柤徧偱奐敪尦偺僐乕僯儞呮幮摍偐傜巗斕偝傟偰偄傞偨傔丄梕堈偵擖庤壜擻偱偁傞偙偲偑CPG偑扴懱偲偟偰傛偔梡偄傜傟偰偄傞堦偮偺棟桼偱偁傠偆丅
CPG傪娷傓柍婡懡岴幙嵽椏偵峺慺傪屌掕偡傞応崌偵偼嫟桳寢崌偵傛傝峺慺偲扴懱傪寢崌偝偣傞扴懱寢崌朄偑庡偵梡偄傜傟傞丅懡岴幙僈儔僗昞柺偵峺慺傪寢崌偝偣傞偨傔偵偼丄昞柺張棟偵傛傝僈儔僗昞柺偵斀墳惈偺崅偄婎傪摫擖偡傞昁梫偑偁傞丅昞柺張棟帋栻偲偟偰偼兞-傾儈僲僾儘僺儖僩儕僄僩僉僔僔儔儞乮兞-APTES乯偑峀偔梡偄傜傟偰偄傞丅兞-APTES偵傛傞僈儔僗昞柺偺夵幙偼埲壓偺傛偆偵峴傢傟傞丅
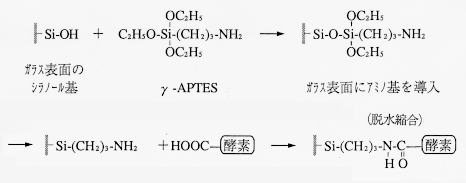
偙偺傛偆偵偟偰僈儔僗昞柺偵摫擖偝傟偨傾儈僲婎偼峺慺撪偺僇儖儃僉僔儖婎偲扙悈弅崌偡傞偨傔丄僈儔僗昞柺偵峺慺偑嫟桳寢崌偝傟傞帠偵側傞丅乮峺慺傪峔惉偡傞傾儈僲巁偵偼懁嵔偵僇儖儃僉僔儖婎傪帩偮傕偺偑懡偔懚嵼偡傞乯
幚嵺偵峺慺傪屌掕壔偡傞嵺偵偼丄忋婰偺曽朄偩偗偱側偔師偵帵偡傛偆偵峏偵昞柺夵幙偑峴傢傟傞丅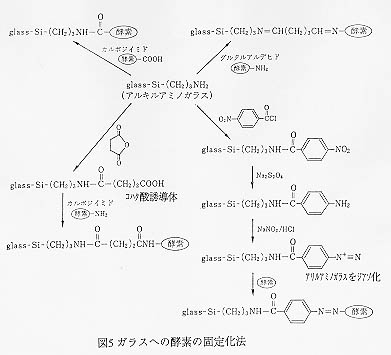
恾6偼Lappi傜偑恾5偵帵偟偨曽朄偱僸僪儘僎僫乕僛傪僈儔僗價乕僘昞柺偵屌掕壔偟丄屌掕壔峺慺偺埨掕惈傪斾妑偟偨寢壥偱偁傞丅偙偺峺慺偼嬻婥暤埻婥壓偱曐懚偟偨応崌偵偼屌掕壔偟偰偄側偄峺慺乮恾拞soluble乯偼悢暘偱妶惈傪幐側偆偺偵懳偟丄屌掕壔偟偨応崌偵偼偄偢傟傕幐妶懍搙偑掅壓偟偰偄傞偙偲偑暘偐傞丅摿偵僐僴僋巁桿摫懱偵屌掕偟偨応崌偵偼4擔曐帩偟偨屻傕屌掕壔捈屻偺栺70亾偺妶惈傪帵偟偰偍傝丄埨掕惈偑挊偟偔岦忋偟偰偄傞偙偲偑暘偐傞丅
懠偺峺慺偵偍偄偰傕屌掕壔帪偺峺慺摿惈偼屌掕壔曽朄偵戝偒偔埶懚偡傞偙偲偑抦傜傟偰偍傝丄屌掕壔峺慺傪嶌惉偡傞嵺偵偼庬乆偺屌掕壔朄傪帋峴偟丄峺慺偵墳偠偨屌掕壔曽朄傪扵嶕偡傞昁梫偑偁傞丅
丂恾6偵傕偁傞傛偆偵屌掕壔偵傛傝峺慺偺埨掕惈偼堦斒揑偵岦忋偡傞偑丄偦偺棟桼偼師偺傛偆偵悇應偝傟偰偄傞丅愭偵弎傋偨傛偆偵峺慺乮僞儞僷僋幙乯偼暋嶨側棫懱峔憿傪庢偭偰偍傝乮恾3乯丄偦偺棫懱峔憿偑峺慺偺怗攠擻椡傗暔幙幆暿擻椡偵戝偒偔嶌梡偟偰偄傞丅擬傗懠偺壔妛栻昳摍偵傛傝棫懱峔憿偑攋夡偝傟傞偲峺慺偺怗攠擻椡偼幐傢傟傞丅偙傟傪峺慺偺曄惈偲偄偆丅峺慺傪屌掕壔偟偨応崌偵偼峺慺亅扴懱娫偵暋悢偺壔妛寢崌偑惗偠傞帠偵傛傝丄堦斒揑偵偼峺慺偺棫懱峔憿偑曗嫮偝傟曄惈偟偵偔偔側傞偲峫偊傜傟傞丅偙傟傪柾幃揑偵帵偟偨偺偑恾7偱偁傞丅峺慺傪岺嬈揑偵巊梡偡傞嵺偵偼丄峺慺偑挿婜娫偵搉偭偰埨掕偵摥偔帠偑媮傔傜傟傞偨傔丄屌掕壔偵傛傞峺慺偺埨掕惈偺岦忋偼岲傑偟偄丅
丂傑偨愭偵弎傋偨傛偆偵僝儖乕僎儖朄偼掅壏偱僈儔僗乮僎儖乯傪崌惉偱偒傞帠偐傜丄峺慺傪僎儖撪晹偵曪妵偡傞帠傕壜擻偱偁傞丅嵟弶偵僝儖乕僎儖朄偵傛傝峺慺傪曪妵屌掕偟偨偺偼僀僗儔僄儖偺Braun傜偱偁傞丅Braun傜偼僥僩儔僄僩僉僔僔儔儞傪娷傓尨椏梟塼偵峺慺傾儖僇儕僼僅僗僼傽僞乕僛傪揧壛偟丄僝儖乕僎儖夁掱傪宱偰傾儖僇儕僼僅僗僼傽僞乕僛傪僎儖拞偵曪妵屌掕偟丄摨峺慺偑僎儖拞偱傕妶惈傪帵偡帠傪曬崘偟偰偄傞丅堦斒偵僝儖乕僎儖朄偱摼傜傟傞僎儖懱偼nm僆乕僟乕偺嵶岴傪桳偟偨懡岴懱偱偁傝丄偙偺応崌丄峺慺偼偙偺傛偆側嵶岴撪偵僩儔僢僾偝傟偰偄傞偲峫偊傜傟傞丅
偙偺曽朄偼慜婰偺懡岴幙僈儔僗偺応崌偵斾傋丄扴懱偺昞柺張棟摍暋嶨側憖嶌傪昁梫偲偣偢丄僝儖乕僎儖朄偺尨椏梟塼偵峺慺傪揧壛偡傞偩偗偱屌掕壔峺慺偑摼傜傟傞偨傔丄娙曋側峺慺偺屌掕壔曽朄偲偟偰嫽枴怺偄曽朄偱偁傞丅斀柺丄僥僩儔僄僩僉僔僔儔儞偺傛偆側斀墳惈偺崅偄帋栻偵傛傝峺慺偑幐妶偡傞壜擻惈偑崅偔丄扴懱偑懡岴惈偱側偄偨傔屌掕壔偟偨峺慺偑桳岠偵棙梡偝傟側偄摍偺寚揰傕偁傝丄崱屻峏偵夵椙偝傟傞帠偑朷傑傟傞丅
 嵍婰偵懡岴幙僈儔僗偺SEM幨恀傪帵偡丅
嵍婰偵懡岴幙僈儔僗偺SEM幨恀傪帵偡丅



